Die „Gute Herstellungspraxis“ oder GMP umfasst Richtlinien zur Qualitätssicherung der Produktionsabläufe und -umgebung unter anderem bei der Herstellung von Arzneimitteln und Medizinprodukten. Ziel ist, ein qualitativ hochwertiger Produktionsprozess – von der Materialbeschaffung bis zur Lagerlogistik – und damit eine hohe Produktqualität. Darüber hinaus soll das Qualitätsmanagement gemäß GMP und ISO 13485 sicherstellen, dass die regulatorischen Anforderungen für die Vermarktung erfüllt sind. Das heißt, in der Medizintechnik ist eine hohe und validierte Produktqualität nicht primär ein Wettbewerbsvorteil oder Differenzierungsmerkmal wie in anderen Industrien, sondern eine unverzichtbare Bedingung.
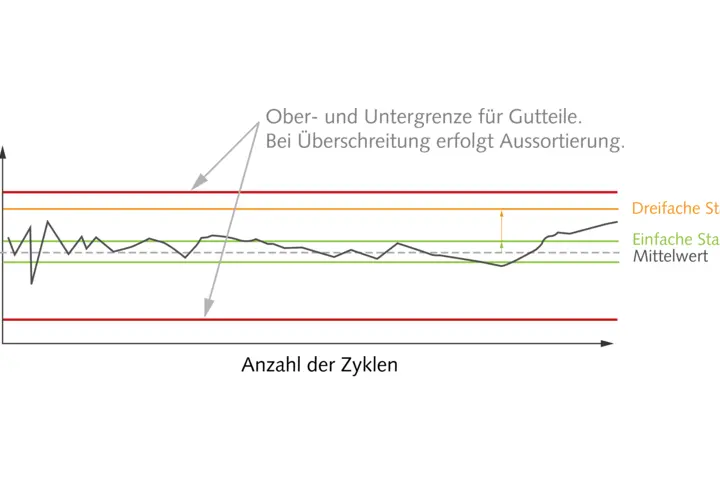
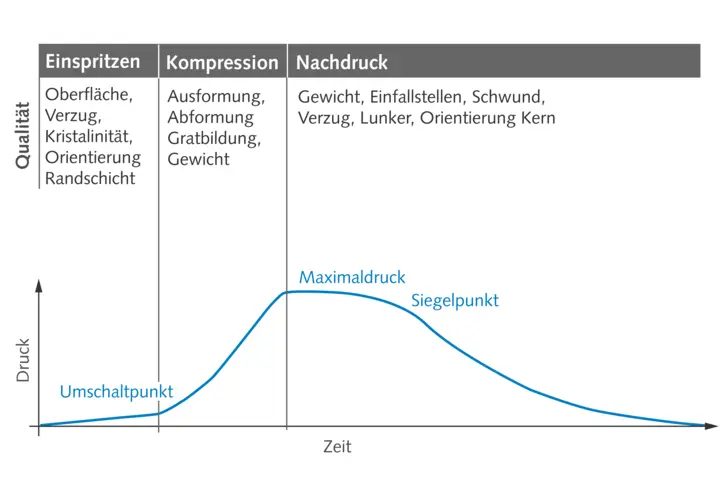
Die Kernstücke der GMP sind die Qualifizierung der Anlagen und Maschinen sowie die Validierung von Prozessen und Methoden. Bei ersterem gilt es, in einem geplanten, mehrstufigen und dokumentierten Prozess zu zeigen, dass die Ausrüstung und Anlagen prinzipiell für den Zweck geeignet sind und unter den Bedingungen vor Ort tatsächlich zuverlässig funktionieren. Auch bei der Prozess- und Methodenvalidierung muss dokumentiert und nachgewiesen werden, dass die eingesetzten Prozesse und Methoden zu verlässlichen und reproduzierbaren Ergebnissen führen und das gefertigte Produkt den Anforderungen entspricht. Um die hohen Ansprüche besonders auch hinsichtlich Dokumentation zu erfüllen, hat sich in der Spritzgießpraxis die Prozessüberwachung mittels Werkzeuginnendruck, auch Forminnendruck genannt, vielfach bewährt. Dieser Parameter ist im Spritzguss die aussagekräftigste Prozessgröße, die den Anwendern vollumfängliche Transparenz über den Formteilbildungsprozess ermöglicht. Dass diese den Anwender bei den Dokumentationspflichten unterstützt, liegt auf der Hand. Darüber hinaus vereinfacht die Überwachung des Werkzeuginnendrucks ebenfalls die Prozessvalidierung beim Einrichten der Maschine und die Optimierung der Abläufe in der Produktion – bis hin zur Null-Fehler-Produktion durch Qualitätsvorhersage-Modelle.